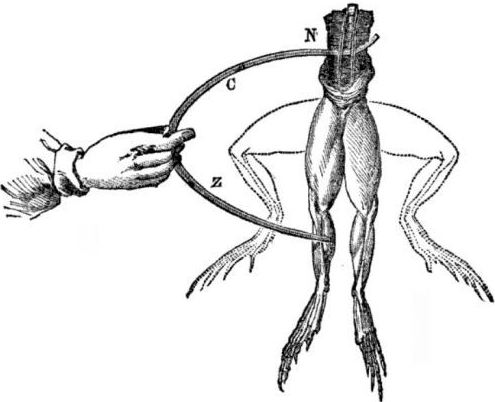
Предпосылки к появлению гальванических элементов. Немного истории. В 1786 году итальянский профессор медицины, физиолог Луиджи Алоизио Гальвани обнаружил интересное явление: мышцы задних лапок свежевскрытого трупика лягушки, подвешенного на медных крючках, сокращались, когда ученый прикасался к ним стальным скальпелем. Гальвани тут же сделал вывод, что это — проявление «животного электричества».
После смерти Гальвани, его современник Алессандро Вольта, будучи химиком и физиком, опишет и публично продемонстрирует более реальный механизм возникновения электрического тока при контакте разных металлов.
Вольта, после серии экспериментов, придет к однозначному выводу о том, что ток появляется в цепи из-за наличия в ней двух проводников из разных металлов, помещенных в жидкость, и это вовсе не «животное электричество», как думал Гальвани. Подергивание лапок лягушки было следствием действия тока, возникающего при контакте разных металлов (медные крючки и стальной скальпель).
Вольта покажет те же явления, которые демонстрировал Гальвани на мертвой лягушке, но на совершенно неживом самодельном электрометре, и даст в 1800 году точное объяснение возникновению тока: «проводник второго класса (жидкий) находится в середине и соприкасается с двумя проводниками первого класса из двух различных металлов… Вследствие этого возникает электрический ток того или иного направления».
В одном из первых экспериментов Вольта опустил в банку с кислотой две пластинки — цинковую и медную — и соединил их проволокой. После этого цинковая пластина начала растворяться, а на медной стали выделяться пузырьки газа. Вольта предположил и доказал, что по проволоке протекает электрический ток.
Так был изобретён «элемент Вольта» — первый гальванический элемент. Для удобства Вольта придал ему форму вертикального цилиндра (столба), состоящего из соединённых между собой колец цинка, меди и сукна, пропитанных кислотой. Вольтов столб высотою в полметра создавал напряжение, чувствительное для человека.
Поскольку начало исследованиям положил Луиджи Гальвани, то и название химического источника тока сохранило память о нем в своем названии.
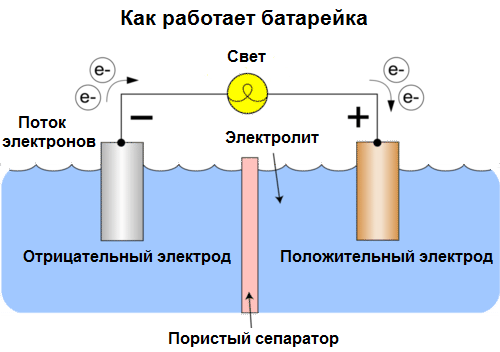
Гальванический элемент — это химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Таким образом, в гальванических элементах химическая энергия переходит в электрическую.
Гальванические элементы сегодня
Гальванические элементы сегодня называют батарейками. Широко распространены три типа батареек: солевые (сухие), щелочные (их называют еще алкалиновыми, «alkaline» в переводе с английского - «щелочной») и литиевые. Принцип их работы — все тот же, описанный Вольта в 1800 году: два металла взаимодействуют через электролит, и во внешней замкнутой цепи возникает электрический ток.
Напряжение батарейки зависит как от используемых металлов, так и от количества элементов в «батарейке». Батарейки, в отличие от аккумуляторов, не способны к восстановлению своих свойств, поскольку в них происходит прямое преобразование энергии химической, то есть энергии составляющих батарейку реагентов (восстановителя и окислителя), в энергию электрическую.
Входящие в батарейку реагенты, в процессе ее работы расходуются, ток при этом постепенно уменьшается, поэтому действие источника заканчивается после того как реагенты прореагируют полностью.
Щелочные и солевые элементы (батарейки) широко применяются для питания разнообразных электронных устройств, радиоаппаратуры, игрушек, а литиевые чаще всего можно встретить в портативных медицинских приборах типа глюкометров или в цифровой технике вроде фотоаппаратов.
Солевые батарейки
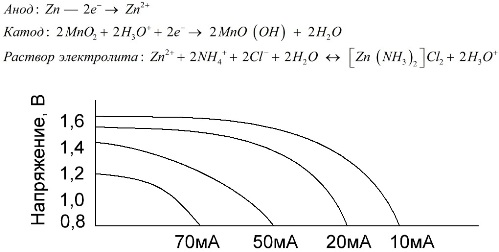
Марганцево-цинковые элементы, которые называют солевыми батарейками — это «сухие» гальванические элементы, внутри которых нет жидкого раствора электролита.
Цинковый электрод (+) — это катод в форме стакана, а анодом служит порошкообразная смесь из диоксида марганца с графитом. Ток течет через графитовый стержень. В качестве электролита используется паста из раствора хлорида аммония с добавлением крахмала или муки для загущения, чтобы ничего не текло.
Обычно производители батареек не указывают точный состав солевых элементов, тем не менее, солевые батарейки являются самыми дешевыми, их обычно используют в тех устройствах, где энергопотребление крайне низко: в часах, в пультах дистанционного управления, в электронных термометрах и т. п.
Понятие "номинальная емкость" редко употребляется для характеристики марганцево-цинковых батареек, так как их емкость сильно зависит от режимов и условий эксплуатации. Основными недостатками этих элементов являются значительная скорость снижения напряжения на всем протяжении разряда и значительное уменьшение отдаваемой емкости при увеличении тока разряда. Конечное разрядное напряжение устанавливают в зависимости от нагрузки в интервале 0,7-1,0 В.
Важна не только величина тока разряда, но и временной график нагрузки. При прерывистом разряде большими и средними токами работоспособность батареек заметно увеличивается по сравнению с непрерывным режимом работы. Однако при малых разрядных токах и многомесячных перерывах в работе емкость их может снижаться в следствии саморазряда.
Выше на графике изображены разрядные кривые для средней солевой батарейки за 4, 10, 20 и 40 часов для сравнения с щелочной, о которой речь пойдет далее.
Щелочные (алкалиновые) батарейки
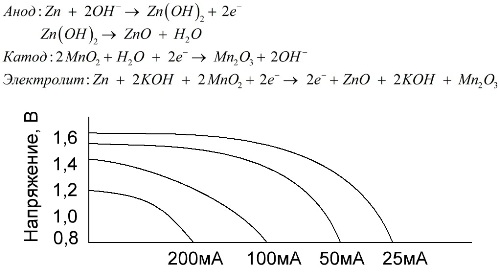
Щелочной элемент питания — марганцево-цинковый гальванический элемент питания, в котором в качестве катода используется диоксид марганца, в качестве анода — порошкообразный цинк, а в качестве электролита — раствор щёлочи, обычно в виде пасты гидроксида калия.
Эти батарейки обладают целым рядом преимуществ (в частности, существенно большей ёмкостью, лучшей работой при низких температурах и при больших токах нагрузки).
Щелочные батарейки, в сравнении с солевыми, могут обеспечивать больший ток в течение длительного времени. Больший ток становится возможным, поскольку цинк здесь используется не в виде стакана, а в виде порошка, обладающего большей площадью соприкосновения с электролитом. В качестве электролита применяется гидрооксид калия в виде пасты.
Именно благодаря способности данного вида гальванических элементов в течение длительного времени отдавать значительный ток (до 1 A), щелочные батарейки наиболее распространены в настоящее время.
В электрических игрушках, в портативной медицинской технике, в электронных приборах, в фотоаппаратах — всюду применяются щелочные батарейки. Они служат в 1,5 раза дольше солевых, если разряд идет малым током. На графике изображены разрядные кривые при различных токах для сравнения с солевой батарейкой (график был приведен выше) за 4, 10, 20 и 40 часов.
Литиевые батарейки
Еще одним достаточно распространенным видом гальванических элементов являются литиевые батарейки - одиночные неперезаряжаемые гальванические элементы, в которых в качестве анода используется литий или его соединения. Благодаря использованию щелочного металла они обладают высокой разностью потенциалов.
Катод и электролит литиевого элемента могут быть очень разными, поэтому термин «литиевый элемент» объединяет группу элементов с одинаковым материалом анода. В качестве катода могут использоваться например: диоксид марганца, монофторид углерода, пирит, тионилхлорид и др.
Литиевые батарейки отличается от других элементов питания высокой продолжительностью работы и высокой стоимостью. В зависимости от выбранного типоразмера и используемых химических материалов, литиевый элемент питания может производить напряжение от 1,5 В (совместим с щелочными батареями) до 3,7 В.
Эти элементы питания обладают наивысшей емкостью на единицу массы и длительным временем хранения. Литиевые элементы широко применяются в современной портативной электронной технике: для питания часов на материнских платах компьютеров, для питания портативных медицинских приборов, наручных часов, калькуляторов, в фототехнике и т. д.
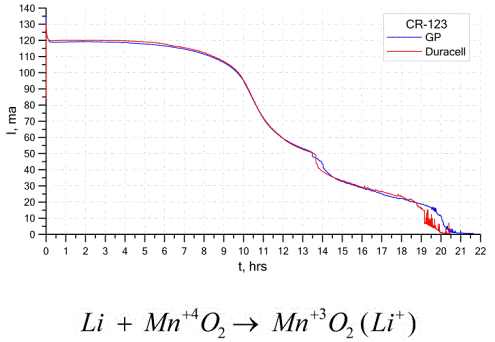
На графике выше приведены разрядные кривые для двух литиевых батареек от двух популярных производителей. Начальный ток составлял 120 мА (на резистор порядка 24 Ома).
Смотрите также: Современные аккумуляторные батарейки - достоинства и недостатки
Андрей Повный